Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Na_2CO_3}=\dfrac{10,6}{106}=0,1\left(mol\right)\\ \rightarrow C_{M\left(Na_2CO_3\right)}=\dfrac{0,1}{0,2}=0,5M\)
Ta có: \(C\%=\dfrac{C_M.M}{10.D}\)
\(\rightarrow C\%=\dfrac{0,5.106}{10.1,05}=5,05\%\)

b)
\(m_{Fe\left(Y\right)}=\dfrac{48.70}{100}=33,6\left(g\right)\Rightarrow n_{Fe\left(Y\right)}=\dfrac{33,6}{56}=0,6\left(mol\right)\)
\(n_{H_2O}=\dfrac{4,816.10^{23}}{6.10^{23}}\approx0,8\left(mol\right)\) => nO(mất đi) = 0,8 (mol)
Xét nFe : nO = 0,6 : 0,8 = 3 : 4
=> CTPT: Fe3O4
c)
Trong tự nhiên, X được tạo ra do hiện tượng oxi hóa sắt trong không khí
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
- Các cách để hạn chế hiện tượng đó:
+ Bảo quản sắt nơi khô ráo, thoáng mát
+ Sử dụng sơn, dầu mỡ chống gỉ sét

a) \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\); \(n_{H_2SO_4}=0,3.0,1=0,03\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
Xét tỉ lệ: \(\dfrac{0,2}{2}>\dfrac{0,03}{3}\) => Al dư, H2SO4 hết
X là Al2(SO4)3; Y là H2; Z là Al(dư)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,02<----0,03-------->0,01
=> m = 5,4 - 0,02.27 = 4,86 (g)
b)\(C_{M\left(Al_2\left(SO_4\right)_3\right)}=\dfrac{0,01}{0,1}=0,1M\)

AXIT: HCl ( axit clohidric) , HNO3 ( axit nitric)
BAZO: NaOH ( Natri hidroxit)
MUỐI: FeSO4 ( Sắt Sunfat) , KCl (Kali clorua), Al2(SO4)3 ( Nhôm Sunfat)
ÕXIT ÃXIT: SO3 ( Lưu huỳnh trioxit) , P2O5 ( ddiPhotpho pentaoxit)
ÕXIT BAZO: FeO (Sắt (2) Oxit), MgO ( Magie Oxit)

2Al+3H2SO4->Al2(SO4)3+3H2
0,188------------------0,0944
n Al=0,188 mol
=>m Al2(SO4)3=0,0944.342=32,2848g
Đáp án+Giải thích các bước giải:
`n_{Al} = m/M = {5,4}/{27}` `= 0,2` `[mol]`
`PTHH :`
`2Al + 3H_2SO_4 -> Al_2[SO_4]_3 + 3H_2uparrow`
Dựa theo phương trình, ta có :
`n_{H_2} = 3/2n_{Al} = 3/2xx0,2 = 0,3` `[mol]`
`->` `V_{H_2 [đktc]} = nxx22,4 = 0,3xx22,4 = 6,72` `[l]`
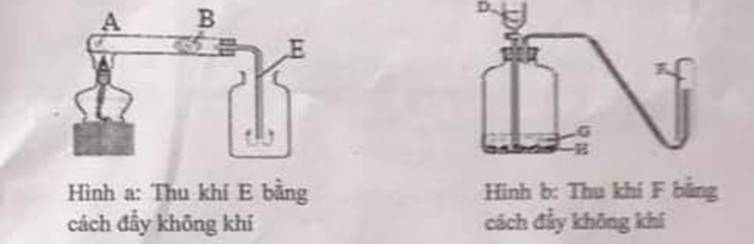
Hộ đi mn