Hỗn hợp khí X gồm 0,1 mol C2H2; 0,2 mol C2H4 và 0,3 mol H2. Đun nóng X với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 11. Hỗn hợp Y phản ứng tối đa với a mol Br2 trong dung dịch. Giá trị của a là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Nhận thấy khối lượng bình brom tăng chính là khối lượng ankin và anken hấp thụ
Bảo toàn khối lượng → mX = mbình tăng + mZ
→ mZ = 0,1.26 + 0,2.28 + 0,1.30 + 0,36.2- 1,64= 10,28 gam

Áp dụng định luật bảo toàn khối lượng ta có:
mđầu = msau ⇒ nđầu.Mđầu = nsau.Msau
→ n s a u n đ ầ u = M đ ầ u M s a u h a y n 2 n 1 = M 2 M 1
Ta có công thức rất quan trọng là
n đ ầ u - n s a u = n 1 - n 2 = n H 2 p h ả n ứ n g - n π phản ứng
Vậy mục tiêu của ta bây giờ là đi tính n2.
Ta lần lượt có n1 = 0,1 + 0,2 + 0,3 = 0,6 mol.
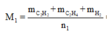
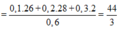
Mà M2 = 11. M H 2 = 11.2 = 22 nên từ:
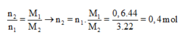
![]()
Phải hiểu rằng n2 = 0,2 mol nghĩa là số mol H2 đã phản ứng là 0,2 mol hay cũng chính là số mol π đã phản ứng là 0,2.
Do đó để tính a là số mol tối đa hỗn hợp Y phản ứng với Br2 trong dung dịch thì ta chỉ cần lấy số mol π ban đầu trừ đi số mol π ban đầu đã phản ứng, hay ta có
a = nπ (đầu) – nπ (đã phản ứng) = 0,1.2 + 0,2.1 –(0,6 – 0,4) = 0,2 mol
Đáp án B

Bài tập này vẫn khá dễ và hơi “kinh điển”
Nhìn chung các bài toán về các phản ứng cộng hidro, tách hidro, crakinh…của hidrocacbon vẫn có cách giải gần tương tự nhau, và ở bài toán này cũng như vậy
![]()
![]()
Xét tỉ lệ quen thuộc:
![]()
Bảo toàn số liêt kết pi ta có: nB =2.04 + 1.0,2-0,2 = 0,2 mol
![]()
![]()
Bài toán số liên kết pi ta có:
![]()
Đáp án D.

Đáp án B
BTKL: Þ mY = mX = 0,1.26. + 0,2.28 + 0,3.2 = 8,8 (gam)
Þ MY = 11.2 = 22 Þ nY = 0,4 mol
Số mol H2 tham gia phản ứng là: nX – nY = (0,1 + 0,2 + 0,3) – 0,4 = 0,2 mol
![]()
![]()
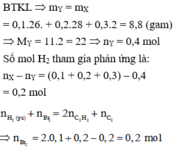
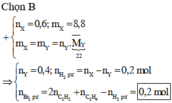




\(m_T=8,8\left(g\right)=m_S\\ \Rightarrow n_S=0,4\left(mol\right)\\ \Rightarrow n_{H_2\left(S\right)}=n_S-n_{HDCB}=0,1\left(mol\right)\\ \Rightarrow n_{H_2\left(pứ\right)}=0,2\left(mol\right)\)
BT liên kết π \(\Rightarrow n_{Br_2}=2n_{C_2H_2}+n_{C_2H_4}-n_{H_2\left(pứ\right)}=0,2\left(mol\right)\)