Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




Bài giảng học thử
Video không hỗ trỡ trên thiết bị của bạn!
Bài 4. Chất béo (P1) - Hóa học lớp 9 - cô Hương Giang
Video không hỗ trỡ trên thiết bị của bạn!
Chuyên đề 2. Các oxit của cacbon (P2) - Ôn luyện Hóa học lớp 9 - cô Trịnh Mỹ Hạnh
Video không hỗ trỡ trên thiết bị của bạn!
Chuyên đề 9. Tính theo phương trình hóa học (tiết 2 - P1) - Ôn luyện Hóa học lớp 9 - cô Trịnh Mỹ Hạnh
Video không hỗ trỡ trên thiết bị của bạn!
Chuyên đề 4. Bazơ (P1) - Ôn luyện Hóa học lớp 9 - cô Trịnh Mỹ Hạnh
Video không hỗ trỡ trên thiết bị của bạn!
Bài 1. Tính chất của kim loại (P1) - Hóa học lớp 9 - cô Hương Giang


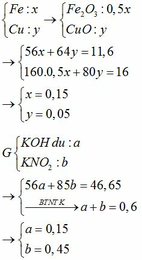
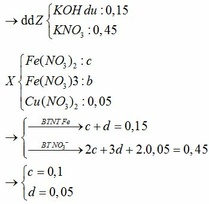

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

nBaCl2 = 2 . 0,2 = 0,4 mol
nNa2SO4 = 1. 0,3 = 0,3 mol
BaCl2 + Na2SO4 -> BaSO4v\(\downarrow\) + 2NaCl
0,4(dư);0,3(hết) --->0,3--------->0,3
mBaSO4 = 0,3 . 233=69,9 g
CM(NaCl) = \(\dfrac{0,3}{0,5}\) = 0,6 M
a) BaCl2 + Na2SO4 → 2NaCl + BaSO4↓
\(n_{BaCl_2}=0,2\times2=0,4\left(mol\right)\)
\(n_{Na_2SO_4}=0,3\times1=0,3\left(mol\right)\)
Theo PT: \(n_{BaCl_2}=n_{Na_2SO_4}\)
Theo bài: \(n_{BaCl_2}=\dfrac{4}{3}n_{Na_2SO_4}\)
Vì \(\dfrac{4}{3}>1\) ⇒ BaCl2 dư, Na2SO4 hết ⇒ Tính theo Na2SO4
b) Theo PT: \(n_{BaSO_4}=n_{Na_2SO_4}=0,3\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=0,3\times233=69,9\left(g\right)\)
c) \(\Sigma V_{dd}saupư=200+300=500\left(ml\right)=0,5\left(l\right)\)
Theo PT: \(n_{NaCl}=2n_{Na_2SO_4}=2\times0,3=0,6\left(mol\right)\)
\(\Rightarrow C_{M_{NaCl}}=\dfrac{0,6}{0,5}=1,2\left(M\right)\)
Theo PT: \(n_{BaCl_2}pư=n_{Na_2SO_4}=0,3\left(mol\right)\)
\(\Rightarrow n_{BaCl_2}dư=0,4-0,3=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{BaCl_2}}dư=\dfrac{0,1}{0,5}=0,2\left(M\right)\)

PTHH : BaCl2 + H2SO4 -> BaSO4 + 2HCl
..............0,1...........0,1............0,1...........0,2 (mol)
nBaCl2 = \(\dfrac{200.1}{1000}=0,2\left(mol\right)\)
nH2SO4 = \(\dfrac{200.0,5}{1000}=0,1\left(mol\right)\)
Vì 0,1<0,2 => BaCl2 dư
nBaCl2 dư = 0,2-0,1=0,1(mol)
mA = 0,1.233=23,3(g)
b , Trong B có : 0,2 mol HCl và 0,1 mol BaCl2 dư
Chỗ này bạn nên nói rõ là nồng độ mol hay nồng độ phần trăm ??!

\(n_{CuCl_2}=0,075mol\)
\(n_{NaOH}=0,05.2=0,1mol\)
CuCl2+2NaOH\(\rightarrow\)Cu(OH)2\(\downarrow\)+2NaCl
-Tỉ lệ: \(\dfrac{0,075}{1}>\dfrac{0,1}{2}\)suy ra CuCl2 dư
CuCl2+2NaOH\(\rightarrow\)Cu(OH)2\(\downarrow\)+2NaCl
0,05..\(\leftarrow\)0,1\(\rightarrow\).......0,05\(\rightarrow\)........0,1
a=\(m_{Cu\left(OH\right)_2}=0,05.98=4,9gam\)
\(n_{NaCl}=0,1mol\)
\(n_{CuCl_2\left(dư\right)}=0,075-0,05=0,025mol\)
\(V_{dd}=0,075+0,05=0,125l\)
\(C_{M_{NaCl}}=\dfrac{0,1}{0,125}=0,8M\)
\(C_{M_{CuCl_2}}=\dfrac{0,025}{0,125}=0,2M\)
theo đề bài ta có : \(\left\{{}\begin{matrix}nCuCl2=0,075.1=0,075\left(mol\right)\\nNaOH=0,05.2=0,1\left(mol\right)\end{matrix}\right.\)
PTHH :
\(CuCl2+2NaOH->Cu\left(OH\right)2\downarrow+2NaCl\)
0,05mol.........0,1mol...........0,05mol............0,1mol
Theo pthh ta có : \(nCuCl2=\dfrac{0,075}{1}mol>nNaOH=\dfrac{0,1}{2}mol=>nCuCl2\left(d\text{ư}\right)\) ( tính theo nNaOH)
a) PTHH :
\(Cu\left(OH\right)2-^{t0}->CuO+H2O\)
0,05mol........................0,05mol
=> a = mCuO = 0,05.80 = 4 (g)
b) Ta có :
\(\left\{{}\begin{matrix}CM_{NaCl}=\dfrac{0,1}{0,075+0,05}=0,8\left(M\right)\\CM_{CuCl2\left(d\text{ư}\right)}=\dfrac{0,075-0,05}{0,075+0,05}=0,2\left(M\right)\end{matrix}\right.\)
vậy...