
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Phương trình điều chế hiđro
CH4 + 2H2O -to, xt→ CO2 + 4H2
Phương trình loại khí oxi:
CH4 + 2O2 -to→ CO2 + 2H2O
Phương trình tống hợp amoniac:
N2 + 3H2 -450-500o, Fe, 200-300atm→ 2NH3

N 2 (k) + 3 H 2 (k) ↔ 2 N H 3 (k)
Số mol khí ban đầu :
2 7 0
Số mol khí đã phản ứng :
x 3x
Số mol khí lúc cần bằng :
2 - x 7 - 3x 2x
Tổng số mol khí lúc cân bằng : (2 - x) + (7 - 3x) + 2x = 9 - 2x
Theo đề bài : 9 - 2x = 8,2 ⇔ x = 0,4
1. Phần trăm sô mol nitơ đã phản ứng: 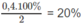
2. Thể tích (đktc) khí amoniac được tạo thành: 2.0,4.22,4 = 17,9 (lít).

Đáp án B
Ta có trong 10 lít khí thiên nhiên có 9,6 lít CH4; 0,2 lít N2 và 0,2 lít CO2.
Đốt cháy khí thiên nhiên có phản ứng hóa học sau:
CH4 + 2O2 → t o CO2 + 2H2O
Ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol.
→ Cứ 9,6 lít CH4 phản ứng cần 9,6.2 = 19,2 lít O2.

Nhiệt lượng cần để đun nóng 100 lít nước từ 20oC lên 100oC là:
4,18.(100 - 20).(100.103) = 33 440 000 (J) = 33 440 (kJ)
Gọi số mol khí thiên nhiên là x (mol)
⇒ nCH4 = 0,85x (mol) ; nC2H6 = 0,1x (mol)
Nhiệt lượng toả ra khi đốt cháy metan là: 880.0,85x = 748x (kJ)
Nhiệt lượng toả ra khi đốt cháy etan là: 15600.0,1x = 156x (kJ)
⇒ 748x + 156x = 33440
⇒ x = 36,991 (mol)
Vậy thể tích khí thiên nhiên cần dùng là:
36,991.22,4 = 828,6 (lít) (đktc)

CH4 + 2H2O 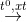 CO2 + 4H2
CO2 + 4H2
CH4 + 2O2 (kk) 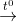 CO2 + 2H2O nên còn lại N2
CO2 + 2H2O nên còn lại N2
N2 + 3H2 \(\Leftrightarrow\)2NH3
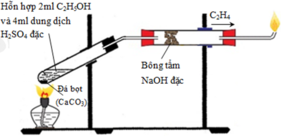
CH4 + 2H2O 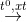 CO2 + 4H2
CO2 + 4H2
CH4 + 2O2 (kk) 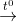 CO2 + 2H2O nên còn lại N2
CO2 + 2H2O nên còn lại N2
N2 + 3H2 ⇔ 2NH3
\(C\cong O\)
- Là chất khí không màu, không mùi, không vị.
- Hơi nhẹ hơn không khí, ít tan trong nước.
- Không duy trì sự cháy, hô hấp. Không độc.
- Là chất khí không màu, không mùi, không vị.
- Tan rất ít trong nước, rất bền với nhiệt.
- Hơi nhẹ hơn không khí, rất độc hại.
\(\star\) Liên kết ba trong phân tử nitơ rất bền.
\(\star\) Ở nhiệt độ cao, nitơ tác dụng được với nhiều chất.
\(\star\) Vừa là chất oxi hoá, vừa là chất khử.
- Tính oxi hoá:
+ Tác dụng với kim loại sinh ra muối nitrua kim loại (M3Nn).
\(6Na+N_2\rightarrow2Na_3N\)
+ Tác dụng với hiđro sinh ra khí amoniac (NH3):
\(N_2+3H_2\underrightarrow{t^\circ}2NH_3\)
- Tính khử:
+ Tác dụng với oxi sinh ra khí nitric oxit (NO) ở khoảng \(3000^\circ C\):
\(N_2+O_2\underrightarrow{t^\circ}2NO\)
\(2NO+O_2\rightarrow2NO_2\) (to thường, hoá nâu)
▲ Chú ý: Các oxit khác của nitơ \(NO_2,N_2O,N_2O_3,N_2O_5,N_4O_6,...\) không được điều chế trực tiếp bằng cách cho nitơ tác dụng với oxi.
\(\star\) Phân tử CO có liên kết ba (2 liên kết chính, 1 liên kết cho-nhận), nên rất bền.
\(\star\) Chỉ hoạt động ở nhiệt độ cao.
\(\star\) Là chất khử mạnh:
- Tác dụng với các phi kim:
+ Với oxi:
\(2CO+O_2\underrightarrow{t^\circ}2CO_2\)
+ Với clo:
\(CO+Cl_2\underrightarrow{t^\circ}COCl_2\) (phosgen)
- Khả năng khử được các oxit của kim loại.
+ Khử đồng(II) oxit:
\(CO+CuO\underrightarrow{t^\circ}CO_2+Cu\)
+ Khử sắt(III) oxit:
\(3CO+Fe_2O_3\underrightarrow{t^\circ}3CO_2+2Fe\)