Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do Flo có tính oxi hóa mạnh nhất nên F- không bị oxi hóa bởi các chất oxi hóa thông thường, mà phải dùng dòng điện.
A sai, vì Clo, brom cũng có tính oxi hóa mạnh mà vẫn điều chế được.
C sai, các hợp chất florua đều có tính khử.
D sai, flo có độ âm điện lớn nhất nhưng không giải thích được điều trên.

Flo không xuất hiện mức oxi hóa dương vì flo là phi kim mạnh nhất trong số tất cả các phi kim nên trong các phản ứng nó chỉ thu thêm e nên luôn luôn có số oxi hoá âm

Khi điện phân hỗn hợp KF trong HF lỏng khan đã được loại bỏ hết nước. Sở dĩ phải tránh sự có mặt của nước vì flo tác dụng với nước cho thoát ra O2
2F2 + 2H2O → 4HF + O2 ↑
Phản ứng thật ra rất phức tạp: đầu tiên phải có phản ứng hóa học:
F2 + H2O → 2HF + O
Một số nguyên tử oxi kết hợp với flo cho OF2. Như vậy ta điều chế không được flo nguyên chất.

Vì nguyên tố R tạo với hidro hợp chất khí có công thức RH3
=> Oxit cao nhất của R là R2O5
Lại có trong R2O5, oxi chiếm 56,34% về khối lượng
=> \(\frac{16\times5}{2R+16\times5}\times100\%=56.34\%\)
=> R = 31
=> R là Photpho

1. a. dd KI xuất hiện màu đỏ tím, sau đó dần trở lại không màu
Cl2 + 2KI \(\rightarrow\) 2KCl + I2 và 5Cl2 + I2 + 6H2O \(\rightarrow\) 2HIO3 + 10HCl
b. Quá trình chuyển X2 \(\rightarrow\) 2X- phụ thuộc vào 2 yếu tố: năng lượng phân li phân tử thành nguyên tử (tức năng lượng liên kết) và ái lực e để biến nguyên tử X thành ion X-
Mặc dù ái lực của flo bé hơn clo, nhưng năng lượng liên kết của flo lại thấp hơn của clo nên flo dễ phân li thành nguyên tử hơn, vì vậy tính oxi hóa của flo mạnh hơn clo
(Năng lượng liên kết của flo thấp hơn clo vì: Trong phân tử F chỉ có các AO p, không có AO trống \(\rightarrow\) phân tử F2 chỉ có liên kết \(\sigma\). Trong nguyên tử Cl, ngoài các AO p còn có AO d trống \(\rightarrow\) phân tử Cl2 ngoài sự xen phủ các AO p để tạo liên kết \(\sigma\), thì mây e còn đặt vào AO d trống, do đó tạo một phần liên kết pi).
2. Dựa vào thể tích và khối lượng hỗn hợp khí, lập hệ pt dễ dàng tính được số mol SO2 = 0,06 và NO2 = 0,02 \(\rightarrow\) số mol e nhận = 0,06.2 + 0,02 = 0,14
Nếu tất cả kim loại đều tan thì ne nhường = 0,03.3 + 0,02.2 + 0,02.2 = 0,17 > 0,14. Như vậy có kim loại còn dư, đó là Cu (vì Cu có tính khử yếu nhất), tính được số mol Cu dư = \(\frac{0,17-0,14}{2}\) = 0,015
Ta có : NO3- + 2H+ +1e \(\rightarrow\) NO2 + H2O
0,02 0,04
SO42- +4H+ +2e \(\rightarrow\) SO2 +2H2O
0,06 0,24
nNO3 -(muối) = nNO3- (ax) – nNO2 = nH+ - nNO2 = 0,04 – 0,02 = 0,02
Tương tự tính được nSO42- = 0,06 mol. Khối lượng muối = mkim loại + mgốc axit
\(\rightarrow\) m = 0,03.27 + 0.02.65 + 0,005.64 + 0,02.62 + 0,06.96 = 9,43 (gam)

1.Kết luận nào sau đây không đúng với flo:
A.F2 là khí có màu lục nhạt ,rất độc
B.F2 có tính oxi hóa mạnh nhất trong tất cả phi kim
C.F2 oxi hóa được tất cả các kim loại
D.F2 cháy trong hơi H2O tạo HF và O2
2.Tính chất vật lí đặc biệt của I2 cần được lưu ý là:
A.Iot ít tan trong nước.
B.Iot tan nhiều trong ancol etylic tạothafnh cồn iot dùng để sát trùng.
C.Khi đun nóngiot thăng hoa tạo thành hơi iot màu tím.
D.Iot là phi kim nhưngowr thể rắn
3.Kết luậnnafo sau đâykhoong đúng đối với tính chất hóa học của iot:
A.Iot vừa có tính oxi hóa,vừa có tính khử.
B.Tính oxi hpas của I2>Br2
C.Tính khử của I2>Br2
D.I2 chỉ oxi hóa đươkc H2 ở nhiệt độ cao tạo ra khí HI

A. Flo có tính oxi hóa mạnh, oxi hóa mãnh liệt với nước.
B. Clo có tính oxi hóa mạnh, oxi hóa được nước.
C. Brom có tính oxi hóa mạnh, tuy yếu hơn flo và clo nhưng nó cũng oxi hóa được nước.
D. Iot có tính oxi hóa yếu hơn flo, clo, brom nhưng nó cũng oxi hóa được nước.

Chọn câu đúng khi nói về flo, clo, brom,iot:
A. Flo có tính oxi hóa mạnh, oxi hóa mãnh liệt với nước.
B. Clo có tính oxi hóa mạnh, oxi hóa được nước.
C. Brom có tính oxi hóa mạnh, tuy yếu hơn flo và clo nhưng nó cũng oxi hóa được nước.
D. Iot có tính oxi hóa yếu hơn flo, clo, brom nhưng nó cũng oxi hóa được nước.

Chọn B
Hợp chất khí với Hiđro của một nguyên tố là R H 4 => R có hóa trị IV trong hợp chất khí với H. Hóa trị của R trong hợp chất oxit cao nhất là VIII - IV = IV => Oxit cao nhất là R O 2 .
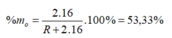
→ R = 28
Vậy R là Si (Silic).
Xét độ âm điện, flo có độ âm điện là 3,98 còn oxi 3,44 nên khi tạo ra \(OF_2\), vì flo có độ âm điện lớn hơn nên oxi có số oxi hoá là \(+2\) (thay vì là \(-2\) trong các oxit). Mặt khác, hiệu độ âm điện là \(0,58>0,4 \&< 1,7\) nên liên kết này phân cực về phía flo, đôi electron chung vì thế cũng bị kéo lệch về phía flo (còn các oxit như \(NO,CO,SO_2\) có đôi electron chung bị kéo lệch về phía oxi). Chính vì thế nên phân tử \(OF_2\) không thể coi là một oxit.
bởi vì oxi bị flo oxi hóa